Irinotécan
Ionisable adj. Se dit dun composé capable de donner des ions par réaction chimique, voire sous linfluence dun phénomène physique.
Ionisation n. f. Au sens général, processus physique ou chimique transformant une substance neutre tel un atome, une molécule ou un radical (libre), en une ou plusieurs espèces chargées appelées ions.
Ionisé adj. Qui a subi une ionisation.
Ionogramme n. m. Ensemble de mesures délectrolytes dans un milieu biologique, exprimés en mÉq/L ou en mmol/L. Lionogramme plasmatique comporte généralement la mesure des ions sodium, potassium, chlorure et bicarbonate, permettant ainsi de calculer léquilibre entre les principaux cations et anions (équilibre ionique et trou anionique).
Ionophore n. m. Petite molécule hydrophobe qui se dissout dans les doubles couches lipidiques membranaires et augmente leur perméabilité à des ions inorganiques spécifiques. Dorigine naturelle (micro-organismes) ou de synthèse, un ionophore agit par transport direct de lion concerné en protégeant sa charge de lenvironnement hydrophobe, ou…
Ionophorèse n. f. Mode dadministration comportant un transport de la substance active par un courant électrique de caractéristiques appropriées.
Iopamidol n. m. Dérivé diamide de lacide triiodo-isophtalique et de lacide lactique amidifié, non ionisé, hydrosoluble, produit de contraste injectable par voie intravasculaire et sous-arachnoïdienne.Inscrit à la Pharmacopée Européenne (monographie 01/2008, 1115).
Iopanoïque (acide) n. m. Produit de contraste iodé. Lacide iopanoïque est un produit de contraste radiologique monomérique, triiodé, ionique.Inscrit à la Pharmacopée Européenne (monographie 01/2016, 0700).
Iopentol n. m. Dérivé O-méthylé de liohexol, produit de contraste triiodé, hydrosoluble, non ionisé.
Iopromide n. m. Dérivé triiodé de lacide isophtalique, non ionisé, mais soluble dans leau.Inscrit à la Pharmacopée Européenne (monographie 07/2009, 1753).
Iotrolane n. m. Produit de contraste radiologique dimérique, hexaiodé, non ionique.Inscrit à la Pharmacopée Européenne (monographie 01/2008, 1754).
Iotroxate (méglumine) n. m. Produit de contraste pour cholécystographie et cholangiographie.Inscrit sur la liste complémentaire des Médicaments essentiels de lOMS.
Ioversol n. m. Dérivé triiodé de lacide isophtalique, non ionisé, mais soluble dans leau.
Ioxaglique (acide) n. m. Composé formé par lunion, via une molécule de glycine, de deux molécules dun dérivé isophtalique triiodé.Inscrit à la Pharmacopée Européenne (monographie 01/2016, 2009).
Ioxitalamique (acide) Dérivé triiodé de lacide isophtalique.
IPEC (International pharmaceutical excipients council) Conseil International des Excipients PharmaceutiquesFédération mondiale, créée en 2010, comprenant quatre groupements régionaux, respectivement IPEC Americas, créé en 1991, IPEC Europe, IPEC Japon (JPEC), créés en 1992 et IPEC China créé en juillet 2008. Elle rassemble les industriels fabricants et distributeurs dexcipients et les industries…
Ipécacuanha n. m. Sous-arbrisseau vivace par un rhizome (Carapichea ipecacuanha (Brot.) L. Andersson, Rubiaceae) poussant dans les forêts tropicales humides du Brésil et de l’Amérique centrale. Les parties souterraines, riches en amidon, contiennent des alcaloïdes isoquinoléino-monoterpéniques, dont le principal est l’émétine, à activité émétique, expectorante et amœbicide ;…
Ipilimumab n. f. Anticorps monoclonal entièrement humanisé anti-CTLA-4 (IgG1 kappa) produit dans des cellules ovariennes de hamster chinois par la technique de lADN recombinant. Lipilimumab se lie à une molécule appelée lantigène 4 des lymphocytes T cytotoxiques (CTLA-4 ou cytotoxic T cells antigen-4), se trouvant à la surface…
Ipomoea Genre Ipomoea L. de la famille des Convolvulaceae renfermant de très nombreuses espèces réparties surtout dans les régions chaudes et tropicales, exceptionnellement en Europe méridionale. Du point de vue nomenclature, il existe une confusion liée à de nombreuses synonymies. Ce sont souvent des lianes à…
Ipratropium n. m. Dérivé hémisynthétique ammonium quaternaire de latropine (N-isopropylatropine) ; bronchodilatateur anticholinergique par action antagoniste des récepteurs muscariniques de lacétylcholine.Inscrit sur la liste des Médicaments essentiels de lOMS et à la Pharmacopée Européenne, monographie 01/2008, 0919 (bromure d).
Iproniazide (phosphate d') n. m. Dérivé N-isopropylé de lisoniazide, inhibiteur non spécifique et irréversible de la monoamine-oxydase.
Iptacopan n. m. Petite molécule de synthèse, qui est un inhibiteur du facteur B, protéine de la voie alterne du complément [1].En se liant au facteur B, il régule le clivage de la protéine C3, la formation de la C3-convertase alterne et la production d’effecteurs en aval, ainsi…
Irbésartan n. m. Antihypertenseur. Ce dérivé de la famille des sartans est un antagoniste de langiotensine II au niveau des récepteurs de type AT1.Inscrit à la Pharmacopée Européenne (monographie 04/2010, 2465).
Iridaceae Famille de plantes herbacées à feuilles linéaires, couchées ou volubiles et à fleurs hermaphrodites. Composée de 2000 espèces (Monoporées - Monocots dans la nouvelle classification), elle présente un androcée limité par la perte du verticille interne détamines et lapparition dune légère zygomorphie chez certains genres…
Iridium n. m. , élément de transition (neuvième famille de la classification périodique). suffixe –ium utilisé pour créer des noms de matériaux
Iridoïde n. m. Nom générique pour un vaste groupe de monoterpènes cycliques oxygénés à squelette cyclopentanopyranique substitué caractéristique (squelette « iridane ») ; majoritairement présents sous forme dhétérosides. Par la présence dun cycle pyrannique accolé, les iridoïdes au sens strict sont des composés bicycliques dans lesquels les variations…
Iris n. f. Nom générique de plantes appartenant à la famille des Iridaceae. La fleur est remarquable et particulièrement élégante et colorée, hermaphrodite et composée de tépales externes et internes, de stigmates pétaloïdes, détamines avec un ovaire infère. Les iris sont abondants dans la zone tempérée de lhémisphère…
Irradiation n. f. Exposition partielle ou totale, volontaire ou accidentelle, dun organisme ou dune substance à un rayonnement ionisant (rayons alpha, bêta, gamma, X, électrons, protons, neutrons) ou non ionisant.
Irrigation n. f. Apport deau sur un terrain.
Irritation n. f. 1- État de sensibilité excessive, d’énervement ou de surexcitation ; 2- État dun organe, dun tissu présentant une légère inflammation réversible, par agression d’un agent chimique, physique ou par traumatisme.
Isatine n. f. Dérivé indolique de couleur orangée, présent notamment dans le pastel des teinturiers (Isatis tinctoria L. Brassicaceae).Inscrite à la Pharmacopée Européenne (monographie 1046800).
Isatuximab n. m. Anticorps monoclonal cytolytique dirigé contre le cluster de différenciation CD38 (ou ADP-ribosyle cyclase), glycoprotéine transmembranaire de type 11 surexprimée à la surface de certaines cellules tumorales (myélome multiple et autres hémopathies malignes). C’est une immunoglobuline G1 chimérique, produite dans des cellules ovariennes de…
Isavuconazole Cf Isavuconazonium sulfate.
Isavuconazonium sulfate n. m. Précurseur pharmacologique (prodrogue) de l’isavuconazole, dérivé atriazole, composé antifongique. L’isavuconazole est un inhibiteur de la lanostérol 14α-déméthylase, l’enzyme responsable de la conversion du lanostérol en ergostérol. La déplétion en ergostérol et l’accumulation de lanostérol modifient la structure de la membrane cellulaire des champignons.…
Ischémie n. f. Nécrose du tissu ou dun organe par diminution ou arrêt de lapport en oxygène par la circulation artérielle qui le vascularise.
Iscom n. m. Nom de complexes immunostimulants dans lesquels lantigène, sous forme de nanoparticule, est enfermé dans une matrice lipidique à base de saponine qui a un rôle dadjuvant permettant la présentation des peptides aux molécules des classes 1 et 2 du complexe majeur dhistocompatibilité. Lantigène est sous…
Iséthionique (acide) Acide sulfonique, HO-CHH, donnant avec les composés basiques des sels bien cristallisés dont certains sont utilisés en thérapeutique comme antiseptique (exemple : di-iséthionate dhexamidine).
ISO (International organization for standardization )
Isobare adj. Qualifie un phénomène ou une transformation qui se déroule à pression constante.
Isochore adj. Qualifie un phénomène ou une transformation qui se déroule à volume constant.
Isochrone adj. Qualifie des phénomènes ou transformations dégale durée.
Isoconazole (nitrate d') n. m. Dérivé de limidazole, non nitré, mais substitué par des chaînes comportant des noyaux benzéniques chlorés.
Isocratique adj. Terme utilisé en chromatographie délution signifiant que, au cours de celle-ci, la composition de la phase mobile ne change pas.
Isodysomie n. f. Présence dans une cellule diploïde de deux chromosomes identiques hérités de lun des parents seulement.
Isoenzyme n. f. Une des formes sous laquelle peut se présenter une enzyme. Les isoenzymes exercent la même réaction catalytique, mais diffèrent par leur structure primaire, voire quaternaire et, par suite, par leurs caractères physicochimiques et immunologiques. Sont souvent spécifiques dun tissu ou dun organe et peuvent exercer…
Isoeugénol n. m. Composé aromatique de la famille des desphénylpropènes. Constitué dune molécule de gaïacol substitué par un reste 2-propényle.
Isoflavone n. f. Nom désignant la 3-phényl-1-benzopyran-4-one et, par extension, lensemble des composés possédant ce squelette. Les isoflavones naturelles sont des constituants polyphénoliques dorigine végétale, formés biogénétiquement à partir des flavanones ; existent à létat libre (= aglycones, par exemple génistéine, daidzéine) ou sous forme dhétérosides (O-hétérosides, par…
Isoflurane n. m. Dérivé halogéné volatil, agent danesthésie générale (induction et entretien).Inscrit sur la liste des Médicaments essentiels de lOMS et à la Pharmacopée Européenne (monographie 01/2008, 1673).
Isoforme n. f. Terme général désignant une des formes multiples dune protéine, différant légèrement entre elles par leur séquence en acides aminés.
Isoindole n. m. Benzopyrrole dans lequel lazote nest pas situé sur un sommet adjacent au noyau phényle. Le noyau de lisoindole est présent dans quelques molécules utilisées en pharmacie, par exemple la tétraméthrine à effet antipoux.
→ Isothiocyanate
Irinotécan
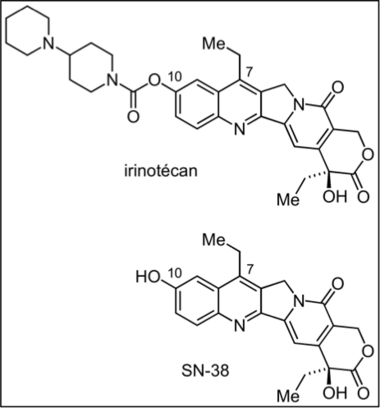
Anglais : irinotecan
Espagnol : irinotecán
n. m. (DCI). Dérivé hémisynthétique de la camptothécine ; précurseur pharmacologique (prodrogue) à fonction carbamate dont l’hydrolyse enzymatique par des carboxyestérases plasmatiques libère le métabolite actif (SN38 : 7-éthyl-10-hydroxycamptothécine) ; agent cytotoxique et antitumoral par action inhibitrice des topoisomérases I, en stabilisant le complexe covalent enzyme-ADN, ce qui aboutit à une cassure monobrin de l’ADN ; il en résulte la mort cellulaire par apoptose.
Inscrit sur la liste des Médicaments essentiels de l'OMS et à la Pharmacopée Européenne, monographie 11/2019, 2675 corrigé 10.1 (chlorhydrate d') trihydraté.
Utilisation de l’irinotécan (chlorhydrate trihydraté) par voie IV, seul ou en association (selon le contexte, avec le 5-fluorouracil et l’acide folinique, ou avec le cétuximab, ou avec la capécitabine, ou avec le bévacizumab) dans le traitement des cancers colorectaux avancés. Toxicité élevée, en particulier hématologique (granulopénie) et intestinale (diarrhées) ; ces diarrhées sont de deux types : diarrhées aiguës (syndrome cholinergique aigu traité par le sulfate d’atropine) et diarrhées retardées (traitées par le lopéramide, par hydratation et apport d’électrolytes).
En 2016, un autre sel d'irinotécan, avec le sucrosofate (saccharose octasulfaté), dans une formulation liposomale pégylée (dénomination retenue pour ce produit : irinotécan liposomal), a obtenu une AMM européenne dans le traitement, en association avec le 5-fluorouracil (5-FU) et la leucovorine (= acide folinique), des adénocarcinomes du pancréas métastatiques chez les adultes en progression de la maladie après un traitement ayant comporté de la gemcitabine. En juin 2020, la FDA lui a accordé la désignation « fast track » (procédure accélérée en vue d’une éventuelle approbation) pour son utilisation expérimentale, en association avec la leucovorine, le 5-FU et l’oxaliplatine, pour les patients atteints d’un adénocarcinome canalaire pancréatique non traité antérieurement, à un stade localement avancé ou métastatique, et non résécable.
Un dérivé pégylé de l’irinotécan, l’ étirinotécan pégol (DCI), également connu sous le nom de « irinotécan pégylé », à durée d’action antitumorale augmentée, est en cours d’évaluation clinique dans divers types de cancers (colorectal, sein, ovaire, poumon, gliome).
Depuis juillet 2019, le SN-38, métabolite actif de l’irinotécan, bénéficie du statut de médicament orphelin pour le traitement du sarcome des tissus mous. Il est également associé, en tant qu’agent cytotoxique, à un anticorps monoclonal (liaison par l’intermédiaire d’un bras espaceur) dans deux immunoconjugués à visée anticancéreuse actuellement en cours d’évaluation clinique :
1- le sacituzumab govitécan (DCI) ; statut de médicament orphelin aux États-Unis pour le traitement du cancer du poumon à petites cellules et du pancréas, et en Europe pour cette dernière indication ; également évalué chez des patientes souffrant d’un cancer du sein triple négatif ;
2- le labétuzumab govitécan (DCI) ; en expérimentation dans le cancer colorectal métastatique chez des patients ayant reçu précédemment au moins un traitement comportant de l’irinotécan.
Le 13 février 2024, la FDA a autorisé une nouvelle forme galénique de l’irinotécan encapsulé dans des liposomes, qui est administrée par voie intraveineuse, en association avec l’oxaliplatine, le fluorouracil et la leucovorine, chez les patients adultes atteints d’un adénocarcinome pancréatique métastatique.