Niraparib
Niacine Cf nicotinique (acide).
Niaouli Cf Melaleuca.
Nicardipine (chlorhydrate de) n. f. Diester dun dérivé nitrophénylé de la dihydropyridine dicarboxylée. Inhibiteur des canaux calciques dépendant du voltage de type L, notamment au niveau du muscle lisse artériel, antihypertenseur.
Nicergoline n. f. Dérivé hémisynthétique à squelette ergoline préparé à partir du lysergol, à activité α-1 bloquante.Inscrite à la Pharmacopée Européenne, monographie 04/2019, 1998.
Nicéthamide n. m. Diéthylamide de lacide nicotinique.Inscrit à la Pharmacopée Européenne (monographie 01/2008, 0233).
Nickel (Ni) n. m. , élément de la 1 colorés).
Niclosamide n. m. Anthelminthique agissant en inhibant la fixation du glucose par le ténia.Inscrit sur la liste des Médicaments essentiels de lOMS et à la Pharmacopée Européenne, monographie 01/2008, 0679 et 680 (niclosamide monohydraté) .
Nicolas-Favre-Durand (maladie de) n. f. Infection sexuellement transmissible, due à Chlamydia trachomatis, sérotypes L1, L2, et L3, caractérisée par une adénopathie inguinale évoluant vers la fistulisation et une anorectite aiguë douloureuse, évoluant vers la suppuration en foyers multiples. Transmission lors de pénétrations anales, vaginales ou buccales…
Nicométhanol (fluorure de) n. m. Sel utilisé dans les pâtes dentifrices et autres produits dhygiène buccale comme vecteur de fluor.
Nicorandil n. m. Ester nitrique dun dérivé du nicotinamide, donneur de monoxyde dazote (NOInscrit à la Pharmacopée européenne (monographie 01/2016, 2332).
Nicotinamide n. m. Amide de lacide nicotinique constitué du noyau pyridine porteur dun groupe CONH2 sur le carbone 3. Vitamine du groupe des vitamines hydrosolubles très répandues dans la nature (improprement nommée vitamine B5 ou B7). Précurseur des cofacteurs doxydoréduction NADInscrit sur la liste des…
Nicotine n. f. Alcaloïde constitué d’une pyrrolidine N-méthylée substituée par un noyau pyridinique ; base forte non oxygénée, liquide et faiblement volatile à température ambiante. Principal alcaloïde de la feuille de tabac (Nicotiana tabacum L. et N. rustica L., Solanaceae) où sa teneur varie de 2 à 10…
Nicotinique adj. Qualifie les effets de la nicotine ainsi que des substances ayant le même mécanisme daction.
Nicotinique (acide) n. m. Acide pyridine-3-carboxylique présent dans le foie, la viande de poule, le lait, la levure, la farine, les capsules surrénales. Au même titre que le nicotinamide dont il est le précurseur et dont il partage certaines activités pharmacologiques (légère action protectrice contre la pellagre), il appartient…
Nidation n. f. Implantation de lœuf dans la muqueuse utérine décidualisée au début de la grossesse, le 7 jour.
Niemann-Pick (maladie de) n. f. Maladie lysosomale héréditaire avec thésaurismose cellulaire de shingolipides et cholestérol. Selon la mutation du gène impliqué, il est différencié les types A, B et C. Les types A et B sont des entités biocliniques très différentes de celle du type C.
Nifédipine n. f. Diester dun dérivé nitrophénylé de lacide dihydropyridine-dicarboxylique, inhibiteur des canaux calciques dépendants du voltage de type L notamment au niveau du muscle lisse artériel (tropisme plus vasculaire que cardiaque).Inscrite sur la liste des médicaments essentiels de lOMS et à la Pharmacopée Européenne (monographie 01/2008, 0627).
Nifekalant (chlorhydrate de) n. m. Antiarythmique. Le nifékalant est un antiarythmique de classe III. Il bloque de manière non spécifique le courant de repolarisation potassique au niveau du myocarde et est dépourvu deffet bloquant β-adrénergique. Il prolonge significativement la durée du potentiel daction et des périodes réfractaires atriales et ventriculaires.
Niflumique (acide) Anti-inflammatoire non stéroïdien polyvalent à noyau pyridine de la classe des fénamates.Inscrit à la Pharmacopée Européenne (monographie 04/2008, 2115).
Nifuroxazide n. m. Anti-infectieux intestinal de la famille du nitrofurane, dont lactivité est reliée à leur capacité, après réduction du groupe NOInscrit à la Pharmacopée européenne (monographie 04/2008, 1999).
Nifurtimox n. m. Dérivé du nitrofurane anti-infectieux, plus spécialement antiprotozoaires.Inscrit sur la liste des Médicaments essentiels de lOMS (traitement de la maladie du sommeil).
Nigelle n. f. Herbacée (Nigella sativa L., Ranunculaceae) présente sur le pourtour méditerranéen, en Asie occidentale et au Moyen-Orient, également cultivée dans les jardins. Graines triangulaires noirâtres renfermant des saponosides, une huile riche en glycérides d’acides gras insaturés, de faibles quantités d’alcaloïdes et une huile essentielle contenant du…
Nilotinib n. m. Antinéoplasique inhibiteur de protéine kinase BCR-ABL exprimée dans les cas de leucémies myéloïdes chroniques à chromosome Philadelphie, y compris pour la plupart des formes mutantes résistantes à limatinib. Il a peu deffet sur la plupart des autres protéines kinases (y compris SRC), à lexception des…
Nilutamide n. m. Dérivé nitré et fluoré dune hydantoïne à propriété antiandrogène.Inscrit à la Pharmacopée européenne (monographie 07/2008, 2256).
Nimésulide n. m. Anti-inflammatoire et antirhumatismal non stéroïdien (sulfamide) doté de propriétés analgésiques et antipyrétiques. Il agit par inhibition de la cycloxygénase (COX), enzyme intervenant dans la synthèse des prostaglandines. Cette inhibition est préférentielle pour la COX-2.Inscrit à la Pharmacopée Européenne (monographie 07/2013, 1548).
Nimodipine n. f. Vasodilatateur de la classe des dihydropyridines, inhibiteur des canaux calciques de type L. Effets sélectifs au niveau cérébral.Inscrite à la Pharmacopée européenne (monographie 04/2016, 1245).
Nimotuzumab n. m. Antinéoplasique, anticorps monoclonal humanisé à reconnaissance spécifique pour le récepteur du facteur de croissance épidermique (EGFR).
Nintédanib n. m. Dérivé de lindolinone, inhibiteur de tyrosine kinases multiples. Inhibe langiogenèse en annihilant la fonction tyrosine kinase des récepteurs du facteur de croissance endothéliale vasculaire (VEGFR,vascular endothelial growth factot receptor), du facteur de croissance fibroblastique (FGFR, fibroblast growth factor receptor) et du facteur de…
Niobium n. m. , élément de transition, de la 5), comme pour le vanadium. Peu abondant dans la nature (souvent associé au tantale dans les minerais, niobotantalates de fer et de manganèse, niobites ou tantalites), on lutilise, entre autres, dans la métallurgie du fer (inhibiteur de corrosion). Le…
Niosome n. m. Vésicule à base damphiphiles non ioniques et non de phospholipides comme les liposomes (exemple : dérivés du polyglycérol ou de polyoxyéthylèneglycols).
Nirmatrelvir n. m. Petite molécule de synthèse, peptidomimétique, qui est un inhibiteur covalent se liant à la cystéine (Cys 145) catalytique de la principale protéase du coronavirus SRAS-Cov-2 (3C-like protease ou 3CLPRO). Cette protéase, qui correspond à la protéine non structurale de type 5 (nsp5, non structural protein 5) clive 11 sites…
Nirogacéstat n. m. Petite molécule de synthèse, un inhibiteur sélectif de l’action de la gamma sécrétase (γ-GS) qui peut entraîner l’induction d’une apoptose [1] dans les cellules tumorales surexprimant Notch.La protéine membranaire intégrale γ-GS est un complexe protéase [2] à plusieurs sous-unités, qui clive les protéines transmembranaires à…
Nirsévimab n. m. Anticorps monoclonal humain, de type immunoglobuline G1-κ, ciblant les sous-unités F1 et F2 de la glycoprotéine de fusion F du virus respiratoire syncytial (VRS) humain, qui empêche la pénétration intracellulaire du virus, par blocage de la fusion de la membrane virale avec la membrane cytoplasmique…
Nisine n. f. Polypeptide polycyclique de 34 acides aminés biosynthétisé par Lactococcus lactis Lister, par la voie ribosomale suivie de modifications post-traductionnelles complexes. Large spectre bactéricide dirigé notamment contre de nombreuses bactéries à Gram positif.
Nitazène n. m. Membre d’une nouvelle famille d’opioïdes synthétiques de la classe des opioïdes benzimidazolés, plus puissants que le fentanyl. Le risque de surdose accidentelle est important, surtout lorsqu’ils sont combinés à d’autres substances réduisant également les fréquences respiratoire et cardiaque, comme d’autres opioïdes et les benzodiazépines. Les…
Nitazoxanide n. m. Petite molécule de synthèse dérivée du nitrothiazolyl-salicylamide, prodrogue du tizoxanide, activée par désacétylation. Développé initialement pour son action contre les infections parasitaires provoquées par des protozoaires, Cryptosporidium parvum et Giardia lamblia, le nitazoxamide s’est avéré avoir in vitro une action antivirale et antiparasitaire à large…
Nitisinone n. f. Inhibiteur compétitif de la 4-hydroxyphénylpyruvate dioxygénase, enzyme intervenant dans le catabolisme de la tyrosine. Elle prévient ainsi laccumulation de métabolites toxiques, observée lors de la tyrosinémie héréditaire de type I caractérisée par un déficit en fumarylacétoacétate hydrolase, dernière enzyme du catabolisme de la tyrosine.
Nitrate n. m. Sel ou ester de lacide nitrique HNO.
Nitrazépam n. m. Hypnotique de la famille des [1-4]-benzodiazépines à groupement nitré agissant en modulant positivement lactivité des récepteurs gaba-ergiques 1.Inscrit à la Pharmacopée européenne (monographie 04/2010, 0415).
Nitré adj. Qualifie des dérivés de substitution des hydrocarbures aliphatiques (R-NO).
Nitrendipine n. f. Antihypertenseur de la classe des dihydropyridines, inhibiteur des canaux calciques de type L, provoquant une vasodilatation artérielle.Inscrite à la Pharmacopée Européenne (monographie 07/2012, 1246).
Nitreux adj. Qualifie des composés à groupement NO ou libérant facilement le composé NO. Cf NO.
Nitrile n. m. Terme générique pour les composés de formule générale RC≡N. Dérive dun amide par déshydratation et est capable de le redonner par hydratation.
Nitric oxide n. m. Terme anglais dont labréviation est NO, officiellement retenu par lIUPHAR pour désigner le radical libre NO.
Nitrique adj. Qualifie : 1- des esters R-O-NO.
Nitrofurane n. m. Sont considérés comme « dérivés du nitrofurane » des composés colorés à noyau furane aromatique, nitrés sur lun des carbones voisins de loxygène du cycle et comportant, sur lautre, une chaîne de type –CH=N-N< (exemples : nifuroxazide, nifurtimox, nitrofurantoïne). Tous ces composés sont des anti-infectieux…
Nitrofurantoïne n. f. Dérivé du nitrofurane et de lhydantoïne.Inscrite sur la liste des Médicaments essentiels de lOMS et à la Pharmacopée Européenne (monographie 01/2008, 0101).
Nitropenthrite n. m. Ester du pentaérythritol, source de monoxyde dazote (NO) à durée de vie plus longue que la trinitrine.
Nitrophile adj. Caractérise une plante vivant dans des sols riches en composés azotés (surtout dérivés ammoniacaux et nitrates), spécialement au voisinage de lhabitat humain. Exemples : Chenopodiaceae, Brassicaceae, Solanaceae, Urticaceae.
Nitroprussiate n. m. Composé inorganique, dérivé nitré du prussiate.
Nitrosamine n. f. Terme générique pour des composés de formule générale RRN-N=O. Les nitrosamines se forment surtout par action dagents de nitrosation, qui peuvent être des oxydes dazote (NO, NO), des nitrites, des nitrates (éventuellement réduits en nitrites in situ par un processus microbiologique), des composés aromatiques nitrés,…
Nitrosourée n. f. Substance de formule générale R-NH-CO-N(R »)-N=O, génératrice dester isocyanique et, de ce fait, agent carbamoylant.
Nitroxidergique adj. Caractérise des structures, par exemple des interneurones cérébraux, utilisant le monoxyde dazote comme médiateur.
Nitrure n. m. Composé inorganique issu de la combinaison de lazote avec un autre élément. On distingue les nitrures ioniques (Cf électronégativité), les nitrures covalents spécialement de bore ou daluminium et les nitrures interstitiels (Cf élément de transition). On peut considérer un nitrure comme étant un produit de…
Niveau n. m. Hauteur par rapport à un plan horizontal de référence.
Nivellement n. m. Action visant à égaliser les différentes parties dun terrain.
Nivolumab n. m. Anticorps monoclonal, inhibiteur de la voie PD-1/PD-L1 (PD1, Programmed cell death 1 ; PD‑L1, Programmed cell death‑ligand 1). Linteraction de la protéine PD-1, exprimée notamment à la surface des lymphocytes T activés, avec son ligand PD-L1 est à lorigine dune diminution de…
Nizatidine n. f. Dérivé thiazolique, antagoniste des récepteurs histaminiques HInscrite à la Pharmacopée Européenne (monographie 07/2012, 1453).
NMPA (National medical products Administration of China)
→ Noramidopyrine
Niraparib
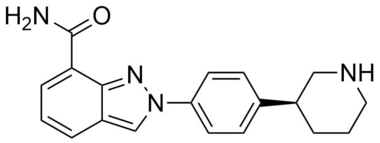
n. m. (DCI). Petite molécule de synthèse, inhibiteur des poly(ADP-ribose) polymérases (PARP-1 et PARP-2), enzymes jouant un rôle important dans la réparation des lésions de l’ADN. Les mécanismes de réparation étant freinés par cette inhibition, les cassures des brins d’ADN ne sont plus réparées, notamment dans les cellules cancéreuses à division rapide ; elles s’accumulent et favorisent l’instabilité génomique conduisant à l’apoptose.
Indiqué, par voie orale, à raison d'une prise quotidienne, dans le traitement des récidives du cancer épithélial de l’ovaire, du cancer des trompes de Fallope, du carcinone péritonéal primitif, chez les patientes répondant complètement ou partiellement à la chimiothérapie par les sels de platine.
Contrairement à un autre anti-PARP, l’olaparib, réservé aux femmes porteuses de mutations BRCA , le niraparib est efficace à la fois chez les patientes présentant des mutations BRCA et celles n’en présentant pas (70 % des patientes).
Autorisation de mise sur le marché accordée par la FDA (États-Unis) le 27 mars 2017. En France, prescription hospitalière restreinte en cancérologie (septembre 2018).
L’association, à doses fixes, de nirapanib (200 mg) qui est un inhibiteur de poly(ADP-ribose) polymérases (PARP-1 et PARP-2) et d’abiratérone (acétate de), qui est un précurseur pharmacologique de l’abiratérone (1000 mg), inhibitrice spécifique de la 17α hydroxylase (ou CYP17A1) dans la synthèse des androgènes testiculaires et surrénaliens, vient d’obtenir son Autorisation de mise sur le marché (AMM), sous le sceau de l’Agence américaine des produits alimentaires et médicamenteux, le 11 août, après l’AMM décernée par l’Agence européenne des médicaments, validée le 19 avril 2023.
Cette association est indiquée, par voie orale quotidienne à jeun, avec 10 mg de prednisone, dans le traitement de patients adultes atteints d’un cancer de la prostate métastatique résistant à la castration et dont les cellules tumorales portent des mutations BRCA 1/2, chez lesquels la chimiothérapie n’est pas cliniquement indiquée.